细胞死亡
细胞死亡是指细胞生命现象的终结。
细胞死亡的进程可以很快,如剧烈的理化因子可使细胞迅速死亡。但在非剧烈因素作用时,细胞死亡有一定的自然过程,尤其从细胞衰老到细胞死亡是一个渐进的过程,并且常有特征性的形态改变:
- 细胞核对各种有害因子的反应最为敏感,如果核内的基因及其控制系统受到损伤,则转录、翻译等过程将中断,细胞的生命过程将改变或停止,细胞接近死亡时,核膜多发生断裂,DNA与蛋白质降解产物泄漏至核外,核仁亦逐渐溶解和消失;
- 胞质内可发生内质网、线粒体肿胀,线粒体嵴断裂和消失;
- 细胞表面微绒毛逐渐减少、消失;
- 细胞的体积因失水而变小或因细胞间水分内渗而变大。
由于细胞死亡原因的多样性,细胞死亡时形态改变的过程和程度也不完全一样。引起细胞死亡的原因很多,细胞死亡的现象也错综复杂。
根据死亡原因的不同,可以将细胞死亡分为正常死亡和非正常死亡。
- 正常死亡一般表现为个体发育过程中的生理性死亡,但在某些病理因素条件下也呈现出这种死亡状态;
- 非正常死亡主要指超过细胞可以承受的强度或阈值的环境因子引起的死亡,以及由于机体病理状态导致的细胞死亡。
一、细胞死亡的方式
在正常生理和病理条件下,细胞可呈现出多种类型的死亡方式,目前发现主要有以下几类:
(一)细胞凋亡
细胞调亡指在特定信号诱导下,细胞内的死亡级联反应被触发所致的生理或病理性、主动性的死亡过程。细胞调亡多发生于生理情况下,也可发生在病理情况下。
细胞调亡时,质膜始终保持完整,胞膜内陷将细胞内容物包被成一些囊状小体,即凋亡小体(apoptotic body),后者被周围吞噬细胞吞噬,不引起炎症反应。
近些年来发现,过度的细胞自噬将导致细胞死亡,因其死亡过程(程序性死亡)同细胞调亡,被称为Ⅱ型凋亡。
(二)细胞坏死
细胞坏死(necrosis)指在外来致病因子作用下,细胞生命活动被强行终止所致的病理性、被动性的死亡过程。
细胞坏死只发生于病理情况下(如创伤、缺血、缺氧等),是非正常死亡。
细胞坏死时,细胞膜和细胞质中细胞器的质膜发生破裂,细胞质外溢,细胞解体并引起周围组织发生炎症反应。
导致细胞坏死的环境因子:
- 可以是物理的,如高温与超低温、高渗与低渗、射线等;
- 也可以是化学的,如化学毒物:
- 还可以是生物的,如细菌和病毒的感染等。
(三)细胞焦亡
细胞焦亡(pyroptosis)又称细胞炎性坏死,表现为细胞不断胀大直至细胞膜破裂,导致细胞内容物的释放进而激活强烈的炎症反应,是一种程序性细胞坏死。
细胞焦亡是机体一种重要的天然免疫反应,在抗击感染中发挥重要作用。相比于细胞凋亡,细胞焦亡发生的更快,并会伴随大量促炎症因子的释放。
二、细胞凋亡的概念与特征
(一)细胞调亡
细胞调亡(apoptosis)是细胞在一定的生理或病理条件下,遵循自身的程序,自己结束其生命的过程。目前很多情况下,细胞调亡亦被称作程序性细胞死亡(programmed cell death,PCD),即在一定时间内,细胞按特定的程序发生死亡,这种细胞死亡具有严格的基因时控性和选择性。
但有些学者认为细胞凋亡与PCD有一定的区别,PCD是一个功能性概念,描述在一个多细胞生物体中,某些细胞的死亡是个体发育中一个预定的,并受到严格控制的正常组成部分,而凋亡是一个形态学概念,指与细胞坏死受到不同的基因控制的细胞死亡形式;PCD的最终结果是细胞调亡,但细胞调亡并非都是程序化的。此外,细胞调亡也可见于PCD之外的病理状态,如抗癌药所致的癌细胞死亡、循环负荷过重引起的细胞死亡等。
细胞调亡现象普遍存在于人类及多种动、植物中,是多细胞生物体个体正常发育、维持成体组织结构不可缺少的部分,贯穿于生物全部的生命活动中,它是细胞生理性死亡的普遍形式。
(二)细胞调亡的特征性形态学变化
主要包括细胞皱缩(cell shrinkage)、染色质凝聚(chromatin condensation)、调亡小体形成、细胞骨架解体等,其中以胞核的变化最为显著。
1.细胞核的变化
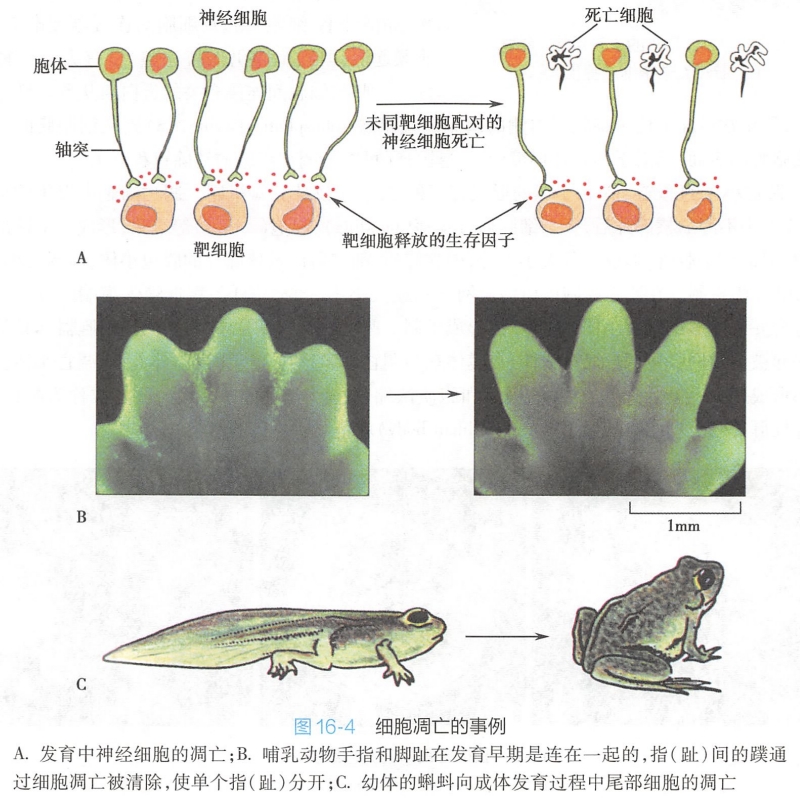
调亡细胞的核DNA在核小体连接处断裂成核小体片段,并向核膜下或中央部异染色质区聚集,浓缩成染色质块,使细胞核呈现新月状、花瓣状等多种形态(图16-5),染色质进一步聚集使核膜在核膜孔处断裂,形成核碎片或核残片。
2.细胞质的变化
由于脱水作用,凋亡细胞的胞质发生明显浓缩,其中的细胞器也发生不同程度的变化,尤其是线粒体和内质网。
凋亡早期,可观察到细胞内线粒体增大,嵴增多,接着线粒体出现空泡化。
多数情况下,凋亡细胞内的内质网腔增殖膨大,并为调亡细胞形成的自噬体结构提供包裹膜。
调亡细胞原有的疏松、有序的细胞骨架结构也变得致密和紊乱。细胞骨架的改变不仅仅是细胞凋亡的后果,还影响到细胞凋亡的过程。
3.细胞膜的变化
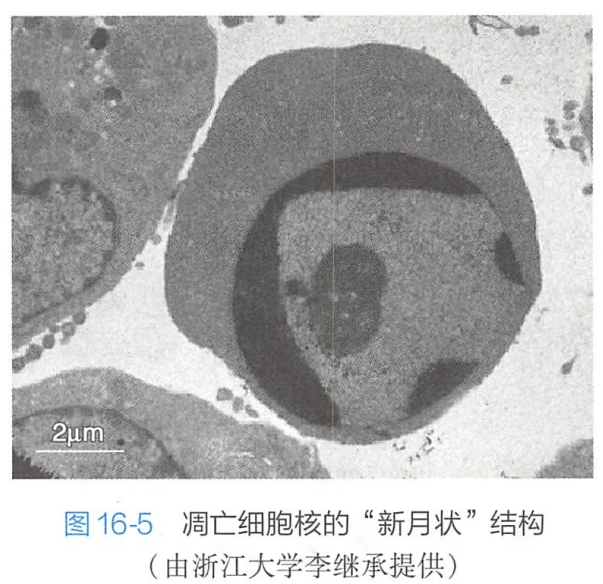
调亡细胞表面原有的特化结构,如微绒毛、细胞突起及细胞间连接等逐渐消失,细胞膜起泡,但细胞膜仍保持完整,没有失去选择通透性。
一些与细胞间连接有关的蛋白质从调亡细胞的膜上消失,但正常情况下位于细胞膜内侧的磷脂酰丝氨酸(phosphatidylserine,PS)则从细胞膜的内侧翻转到细胞膜的表面,暴露于细胞外环境中。这些分子可能与凋亡细胞的清除过程有关。
4.凋亡小体的形成
调亡小体的形成有三种方式:
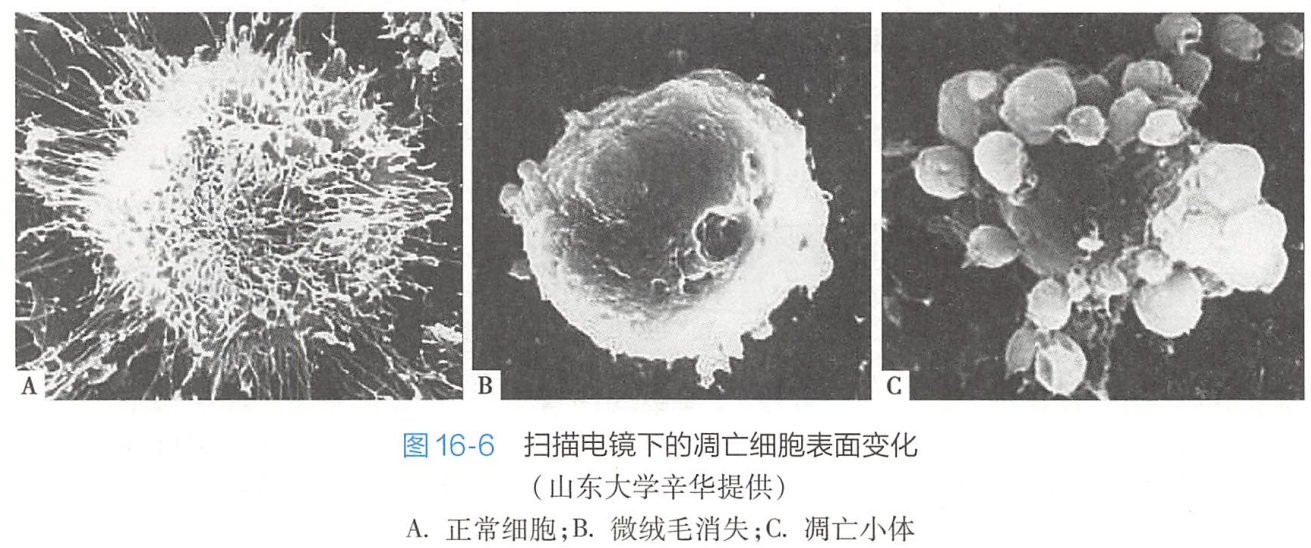
- 发芽脱落机制。凋亡细胞内聚集的染色质块,形成大小不等的核碎片后,整个细胞通过发芽(budding)、起泡(zeiosis)等方式,形成一个球形的突起,并在根部绞窄脱落,形成一些大小不等,内含胞质、细胞器以及核碎片的膜包小体,即凋亡小体(图16-6);
- 分隔机制。在调亡细胞内由内质网分隔成大小不等的分隔区,靠近细胞膜端的分隔膜与细胞膜融合并脱落形成凋亡小体;
- 自噬体形成机制。凋亡细胞内线粒体、内质网等细胞器和其他胞质成分一起被内质网膜包裹形成自噬体,自噬体在与调亡细胞膜融合后排出胞外,形成凋亡小体。
- 有些细胞不形成调亡小体,而仅仅发生核固缩和胞质浓缩,成为单个致密的结构,这也被称为调亡小体。
在病毒性肝炎中见到的嗜酸性小体(councilman body)就是凋亡小体的例子。
(三)细胞凋亡时细胞的生化改变
1.DNA片段化
核小体(nucleosome)是基因组染色体的基本结构,它和连接区(linker)组成核心核小体亚单位(core nucleosomal subunit),总长度为180~200bp。
细胞凋亡时,细胞的内源性核酸内切酶(endonuclease)活化,特异地在连接区切断DNA链。因此,形成长度为180~200bp整数倍的寡聚核苷酸片段,这种DNA片段化(fragmentation)的结果是在进行琼脂糖凝胶电泳时,凋亡细胞表现出特征性的DNA梯状条带(DNA ladder)(图16-7)。
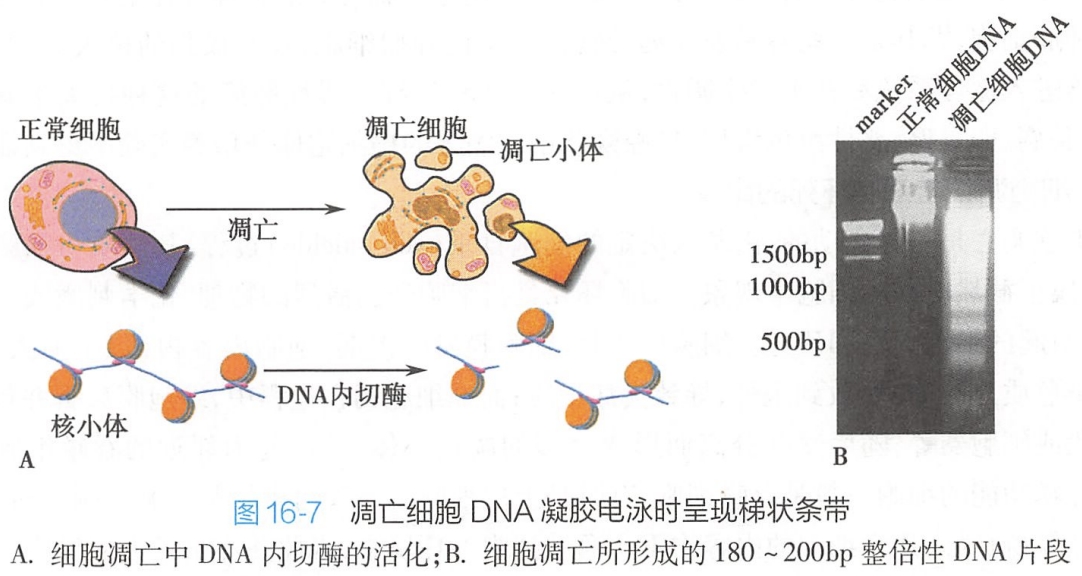
而细胞坏死时,DNA随意断裂为长度不一的片段,琼脂糖凝胶电泳呈“弥散状”(smear)。因此,尽管不是所有凋亡细胞都出现DNA梯状条带,人们仍把它作为细胞调亡最典型的生化特征之一。
2.细胞凋亡中的蛋白酶
细胞调亡的始动,以及发生、发展,主要是通过多种蛋白酶控制的,蛋白酶级联切割可能是凋亡最关键的过程,因此有学者提出蛋白酶的作用是调亡机制的核心部分。
控制调亡的蛋白酶有多种,如胱天蛋白酶(cystein aspartic acid specific protease,caspase)家族、端粒酶或分裂素及钙蛋白酶(calpain)等。
3.胞质Ca2+、pH的变化
有研究认为Ca2+能通过两条途径诱导细胞调亡。
- 一是胞内Ca2+库释放,胞外Ca2+内流使胞质内Ca2+持续升高,作为凋亡信号启动凋亡;
- 二是Ca2+的释放打破了细胞内结构的稳定,使细胞调亡系统的关键成分与正常时不能接触到的基质发生反应,从而触发调亡。
胞内的H+和Ca2+一样,其浓度对生命活动影响重大。用地塞米松诱导巨噬细胞凋亡时,可观察到胞质内的pH先是急速升高,之后又缓慢降低,胞质逐渐酸化,这表明胞质碱化和酸化均能影响细胞凋亡,前者可能与细胞调亡的启动有关,而后者可能是细胞调亡的必然结果。
4.线粒体在细胞凋亡中的作用
细胞调亡有胞核和胞质两条途径,即胞质中的细胞器也是调亡的主要目标,尤其是调亡时,线粒体发生一系列显著的变化:
- 线粒体呼吸链受损,能量代谢受到破坏,导致细胞死亡;
- 线粒体释放细胞色素C(cytochrome C,cytC),而cytC是调亡所必需的胱天蛋白酶家族的激活物;
- 线粒体是细胞产生活性氧类物质(reactive oxygen species,ROS)的主要来源,ROS是细胞调亡的信使分子和效应分子,凋亡时线粒体生成ROS增多;
- 线粒体渗透转变孔(permeability transition pore,PT pore)通透性增高,这是凋亡早期的决定性变化。PT孔是线粒体内膜和外膜在接触部位协同组成的一条通道,PT孔的开放可导致线粒体呼吸链解耦联,并且线粒体内的cyt C可通过开放的PT孔释放至胞质,进而触发caspase级联反应。PT孔开放抑制剂,如环孢素(cyclosporin),能够阻断细胞调亡,表明PT孔在凋亡过程中具有重要作用。 #? (应该与接触转位点不一样吧)
(四)失巢凋亡
失巢凋亡(anoikis)是又一种形式的细胞程序死亡,是因细胞与细胞外基质和其他细胞脱离接触而诱发的。
正常的上皮或内皮细胞具有黏附依赖性,其存活依赖于细胞间和细胞与基质间的信号传递,称为锚定依赖。正常上皮细胞或不具备转移性质的实体瘤细胞从原位脱落进入血流后就会引发细胞凋亡,这种在脱离原来生存环境的特殊情况下发生的细胞凋亡称为失巢凋亡。
这种现象在某些细胞分化生长周期短、组织更新快的细胞中表现更为明显。例如,小肠上皮是人体内更新最快的组织之一,小肠上皮细胞从基底膜移动到上皮表面只需要6~7天的时间。小肠上皮细胞的生长和分化对基底膜的依赖性更为明显。因此,一旦发生脱落,细胞就很容易发生凋亡。在体外培养的情况下,小肠上皮细胞也很容易出现调亡现象,因此经常以小肠上皮细胞作为研究凋亡现象的对象。
除上皮细胞和内皮细胞外,其他类型的细胞也出现失巢凋亡现象,如骨骼肌细胞、某些致瘤潜力低的黑色素瘤细胞以及胚胎成纤维细胞等。
失巢调亡的意义在于防止这些脱落的细胞种植并生长于其他不适宜的地方。而肿瘤细胞,尤其是一些容易发生远处转移的恶性肿瘤细胞,具有极强的抗失巢凋亡特性,从瘤体上脱落进入循环系统后并不发生调亡,从而完成转移过程。
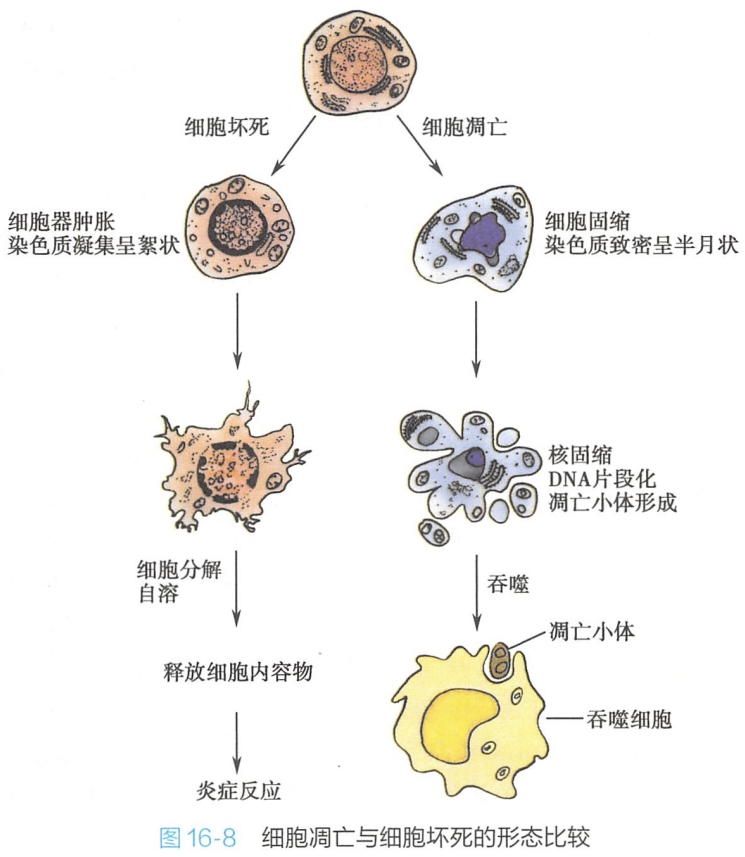
(五)细胞凋亡与细胞坏死的比较
由于细胞调亡是一种主动的、由基因决定的细胞自杀(cell suicide)过程,其性质与细胞坏死完全不同,两者属于截然不同的细胞学现象。

细胞坏死是指细胞受到激烈的物理、化学刺激或严重的病理性刺激后,引起的细胞损伤和死亡。细胞坏死时,细胞膜发生渗漏,细胞内容物(包括膨大、破碎的细胞器以及染色质片段等)释放到胞外,导致炎症反应;而在细胞凋亡过程中,细胞膜反折并包裹断裂的染色质片段或细胞器等,随后逐渐分离而形成众多的调亡小体,并最终为邻近的吞噬细胞所吞噬破坏。行使吞噬功能的细胞一般是巨噬细胞,有时是上皮细胞或血管内皮细胞。整个调亡过程中,细胞膜的完整性保持良好,死亡细胞的内容物不会逸散到胞外环境中,因此并不引发炎症反应(图16-8)。
三、细胞凋亡的影响因素
(一)细胞凋亡的诱发因素
1.生理性诱导因子
肿瘤坏死因子(TNF)及其家族中Fas配体(FasL)、转化生长因子β(TGF-β)、神经递质(谷氨酸,多巴胺,N-甲酰-D-天门冬氨酸)、Ca2+、糖皮质激素等。
2.损伤相关因子
热休克、病毒感染、细菌毒素、原癌基因(如myc,rel,腺病毒E1A等)、抑癌基因(如野生型p53基因)、细胞毒性T淋巴细胞、氧化剂、自由基、缺血、缺氧等。
3.疾病治疗相关因子
化疗、放疗、生物治疗、中药治疗等。
4.其他有某些细胞毒性物质
如乙醇、氧化砷、β-淀粉样肽等。
(二)细胞凋亡的抑制因素
1.生理性抑制因子
如bcl-2原癌基因、突变型p53、各种生长因子、细胞外基质、CD40配体、一些中性氨基酸、锌以及雌、雄激素。
2.病毒基因
如腺病毒E1B、杆状病毒、牛痘病毒crmA、EB病毒BHRF1及LMP-1、单纯疱疹病毒等基因。
3.其他
线虫的ced-9基因、半胱氨酸蛋白酶抑制剂、钙蛋白酶抑制因子、促癌剂(如PMA等)。
四、细胞凋亡的分子机制
(一)调控细胞凋亡的基因
1.调控细胞凋亡的ced基因和caspase基因家族
(1)从线虫中发现调控细胞调亡的ced基因:
有关细胞凋亡的基因调控资料,最早和最完整的都来自对线虫体细胞调亡的研究。
有15个基因在不同程度上与线虫的细胞凋亡有关,并可大致分为4组:
- 第一组基因在线虫的调亡调控中有重要意义,包含ced-3、ced-4和ced-9基因;
- ced-3和ced-4基因:在线虫所有凋亡细胞中,均有ced-3和ced-4的表达,这两个基因的激活是线虫细胞凋亡起始或继续所必需的。
- ced-9基因:ced-9基因的作用与ced-4基因相反。ced-9能抑制胱天蛋白酶的活化,从而抑制线虫体细胞凋亡的发生,因此ced-9也被称为“抗调亡基因”(anti-apoptosis gene)。ced-9的显性突变可阻止那些注定要死亡的细胞不发生调亡,而其突变失活则导致正常情况下应存活的细胞发生调亡。
- 第二组包含7个基因,即ced-1、ced-2、ced-5~ced-8以及ced-10,它们与调亡细胞被吞噬清除过程有关,但与细胞死亡本身无关;
- 第3组包含核酸酶基因1(nmc-1),如果nmc-1发生突变,则DNA裂解受阻,但并不能抑制细胞死亡,这也表明nmc-1并非调亡所必需;
- 第4组是影响特异细胞类型凋亡的基因,包括ces-1、ces-2(ces表示线虫细胞存活的调控基因)以及egl-1和her-1,它们与某些神经元和生殖系统体细胞的调亡有关。
(2)哺乳动物的caspase家族蛋白是ced基因产物的同源体
人们已发现哺乳类细胞中存在ced-3的同源物胱天蛋白酶家族,后者是一组半胱氨酸天冬氨酸酶,它们的共同特点是能特异性地断开天门冬氨酸残基后的肽键。胱天蛋白酶家族有十余个成员,是凋亡过程最重要的影响因素之一,但不同成员在凋亡中起的作用不全相同,如
- caspase-1,caspase-11主要参与白细胞介素前体的活化,并不直接参加调亡的信号转导;
- caspase-2、caspase-8、caspase-9和caspase-10参与凋亡的起始;
- 参与凋亡执行的是caspase-3、caspase-6和caspase-7,它们能降解多种底物,导致核纤层和细胞骨架的断裂崩解等。
目前认为,凋亡的起始者(如caspase-8)与执行者(如caspase-3)之间存在上下游的关系,即起始者活化执行者。
ced-4的哺乳类同源物是细胞凋亡蛋白酶活化因子-1(apoptosis protease activating factor-1,Apaf-1);ced-9与哺乳动物的bcl-2家族具有一定的同源性。
2.既能抑制又能促进细胞凋亡的bcl-2基因家族
bcl-2基因是B细胞淋巴瘤/白血病-2(B-cell ymphoma/leukemia-2,bcl-2)的缩写。bcl-2蛋白不仅存在于B细胞淋巴瘤中,也见于许多正常组织和胚胎组织中,如神经组织、分泌腺的导管细胞、人和胚胎的皮肤,以及胚胎的肾脏与软骨组织。
bcl-2蛋白家族有的成员对凋亡起抑制作用,如bcl-2可防止或延迟由γ-辐射、糖皮质激素、热休克和多种化疗药物所诱导的细胞调亡,故bcl-2基因也被称作“存活基因”(survival gene);但有的是凋亡的促进者,如bad、bax等。
bcl-2家族的氨基酸序列除了在BH1、BH2和 BH3三个区段有高度保守性外,在氨基端还有一个比较保守的区段S1,这可能是调节调亡以及蛋白质相互作用所必需的结构。
3.可促进细胞凋亡的ice基因
白细胞介素-1β转换酶(interleukin-1β converting enzyme,ICE)基因与线虫的ced-3基因在DNA序列上高度同源。
ICE蛋白是一种半胱氨酸蛋白酶,其作用是将前白细胞介素-1β分解成有生理活性的白细胞介素-1β。
ICE过度表达可诱导哺乳动物成纤维细胞发生调凋亡,而ICE的抑制剂,如牛痘病毒cr-mA基因产物可通过抑制ICE阻断凋亡的发生。
4.可触发细胞凋亡的Fas和FasL
Fas是属于肿瘤坏死因子受体(tumor necrosis factor receptor,TNFR)和神经生长因子受体(nerve growth factor receptor,NGFR)超家族的细胞表面分子,Fas配体(Fas ligand,FasL)是TNF家族的细胞表面分子。
人的Fas基因位于第10号染色体的长臂上,FasL的基因定位于第1号染色体,在结构上与TNF-α基因相似。
多种哺乳动物细胞表达Fas,而FasL仅表达于活化的T细胞。FasL与其受体Fas结合将导致携带Fas的细胞凋亡。
Fas/FasL的重要生理作用表现在:
- Fas/FasL触发细胞调亡。抗Fas抗体、表达FasL的细胞,以及可溶性的FasL与Fas交联后均产生细胞凋亡信息;
- Fas/FasL对免疫系统细胞的死亡起重要作用。以Fas为基础的和以穿孔素为基础的机制,是迄今发现的两种T细胞介导的细胞毒机制; #免疫
- Fas/FasL介导免疫“豁免”。正常情况下,眼睛是免疫豁免区,因病毒感染而进入前房的炎症细胞将通过Fas/FasL系统出现调亡,然而缺乏有功能的FasL的突变小鼠在受到感染时,眼内出现了明显的炎症反应。
- Fas系统参与清除活化的淋巴细胞和病毒感染的细胞,而Fas和FasL功能丧失的突变可致淋巴细胞积聚,进而导致自身免疫疾病。
5.参与调节细胞凋亡的p53基因
野生型p53对细胞的生长有负调节作用,从而认定p53是抑癌基因。
p53基因是肿瘤中突变频率最高的抑癌基因,研究表明它能引起细胞周期阻滞,诱导凋亡和促进细胞终末分化,因此与细胞调亡存在密切关系。
人类p53蛋白存在两种形式——野生型(wt p53)和突变型(mt p53),二者均参与调节细胞调亡,但前者对细胞增殖、转化有抑制作用,故能促进凋亡,而后者可灭活前者的功能,抑制凋亡并导致细胞转化和过度增殖而产生肿瘤行为。
现已明确化疗药物、放射线及多种细胞因子等诱导的肿瘤调亡过程中需要p53基因的参加,而糖皮质激素、钙离子载体和衰老等引起的凋亡却无需p53蛋白的存在,其中的确切机制尚不清楚。
目前认为,p53基因产物p53蛋白是转录激活蛋白,作为“基因警卫”维持细胞基因的完整性、DNA损伤的修复以及细胞周期的正常运转。当p53基因缺失或异常时,p53失去监视作用,使细胞带着损伤的 DNA进入S期,结果细胞因遗传不稳定性而产生突变和畸变,最后导致细胞癌变。
可见,p53基因产物诱导细胞凋亡可提供一种防护机制,使DNA损伤的细胞不能存活。
6.c-myc基因既是凋亡的激活因子又是抑制因素
c-myc基因可以产生两种翻译产物c-Myc1和 c-Myc2,两者的作用不同,有时甚至是相反的。
c-myc主要参与转录,在转录过程中可以激活并诱导细胞周期进程和分化,也可以阻止细胞分化或引起调亡,因此它既是凋亡的激活子又是调亡的抑制因素。
c-Myc1和c-Myc2的作用不能一概而论,并受作用细胞的微环境、时期、位点以及自身的质和量的影响。
(二)细胞凋亡的信号转导通路
细胞调亡的信号传导途径具有以下特点:
- 传导途径的启动可因细胞的种类、来源、生长环境及诱因的不同而存在差异:
- 调亡信号传导系统具有多样性;
- 细胞调亡的信号途径与细胞增殖、分化的途径存在一些共同通路:
- 调亡的多条信号途径间存在互通的交叉部分。
现有研究表明,死亡受体和线粒体介导的细胞信号转导通路在细胞调亡中起重要作用(图16-9)。
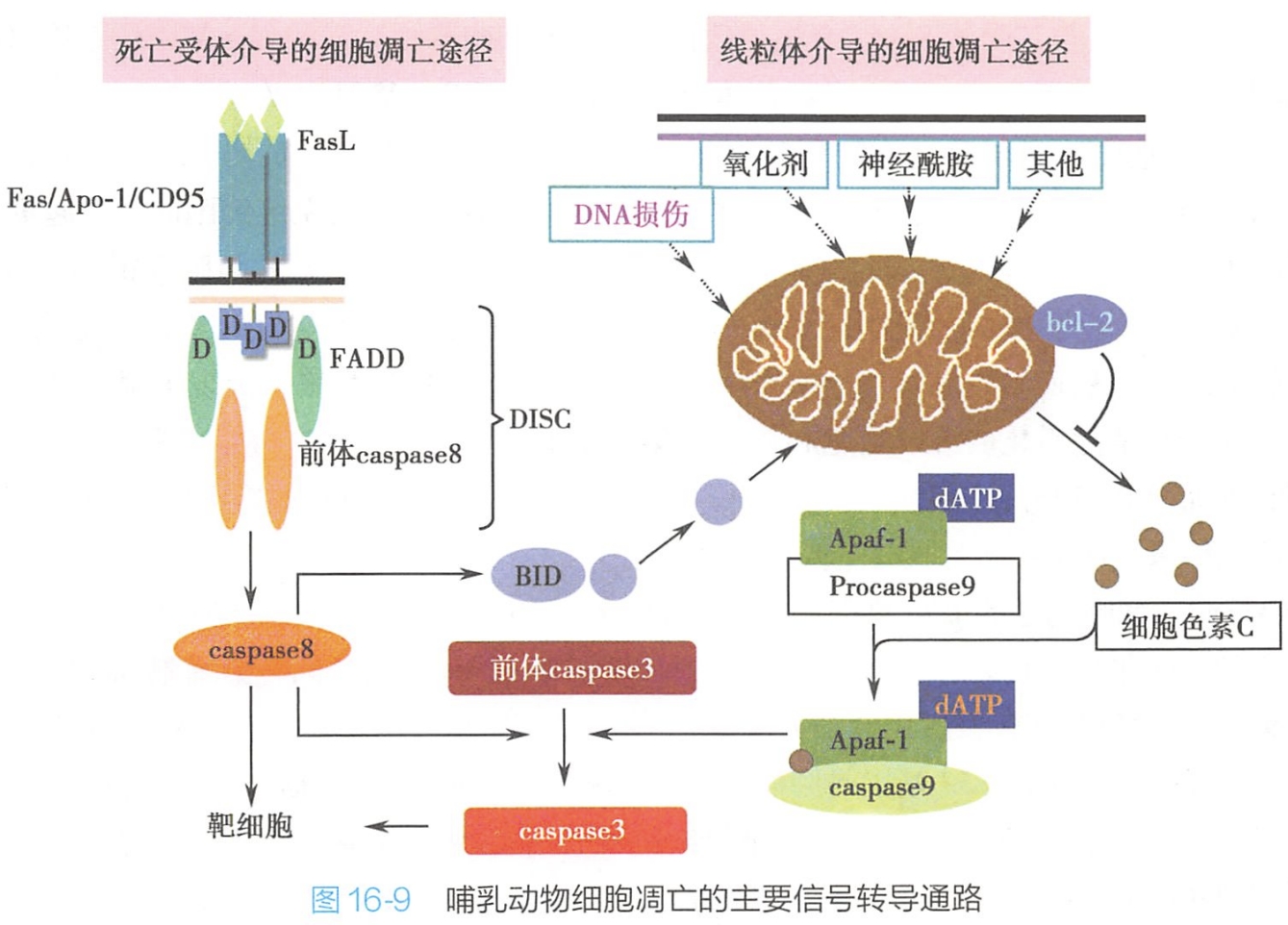
1.死亡受体介导的信号转导通路
细胞外的许多信号分子可以与细胞表面相应的死亡受体(death receptor,DR)结合,激活细胞凋亡信号通路,导致细胞凋亡。
哺乳动物的死亡受体属于肿瘤坏死因子受体和神经生长因子受体超家族,主要成员有Fas/Apo-Ⅰ/CD95、DR-4/TRAIL-R1、DR3/WSL-1/Apo-3/TRAMP等。
配体FasL与死亡受体Fas结合后,诱导Fas胞质区内的死亡结构域(death domain,DD)结合Fas结合蛋白(FADD),FADD再以其氨基端的死亡效应结构域结合caspase-8前体,形成Fas-FADD-caspase-8前体组成的死亡诱导复合物(death inducing signaling complex,DISC),激活caspase-8。
活化的caspase-8可以进一步激活执行死亡功能的效应蛋白caspase-3,6,7等,导致细胞调亡。
2.线粒体介导的信号转导通路
研究表明,线粒体在细胞调亡中处于调亡调控的重要位置,许多凋亡信号(如DNA损伤、氧化剂等)都可以引起线粒体的损伤和膜渗透性改变。
很多bcl-2家族的蛋白,如bcl-2、bax、bcl-XL等都定位于线粒体膜上,bcl-2通过阻止cyt C从线粒体释放来抑制调亡;而 bax则通过与线粒体上的膜通道结合,促使cytC的释放而促进凋亡。
进入胞质的cyt C可以与Apaf-1一起与caspase-9的前体结合,从而导致caspase-9的活化,后者可以激活caspase-3,引起细胞凋亡。
此外,活化的caspase-8,一方面作用于caspase-3前体,另一方面催化BID(bcl-2家族的促凋亡分子)裂解成两个片段,其中含有BH3结构域的C-端片段被运送到线粒体,引起线粒体内cyt C高效释放。BID诱导cyt C释放的效率远高于bax。
最近的研究表明,线粒体内可能存在核酸内切酶G(endonuclease G)、凋亡诱导因子(AIF)和调亡抑制因子(IAP)的抑制蛋白Smac/Diablo,这些蛋白因子可能参与了不依赖caspases的调亡途径。
3.其他转导通路
内质网和溶酶体在细胞调亡中也起重要作用。内质网与细胞凋亡的联系主要表现在两个方面:
- 内质网对Ca2+离子浓度的调控。很多细胞在凋亡早期会出现胞质内Ca2+浓度的升高,这种浓度的升高由细胞外Ca2+的内流和胞内钙库(内质网)中Ca2+的释放所致。胞质内高浓度的Ca2+一方面可以激活胞质中的钙依赖性蛋白激酶,另一方面可影响线粒体外膜的通透性促进细胞调亡。而内质网膜上的凋亡抑制蛋白Bcl-2则具有维持胞质内Ca2+浓度稳定、抑制调亡的作用。
- caspase在内质网的激活。胞质内Ca2+浓度的升高等因素可激活位于内质网膜上caspase-12,活化的 caspase-12被转运到胞质中参与caspase-9介导的凋亡过程。